Автоматизація експерименту і збору експериментальних даних є важливим елементом сучасних наукових досліджень і особливо для кінетичних фізико-хімічних досліджень у яких необхідно здійснювати неперервний контроль певних фізико-хімічних величин. В даній роботі досліджується чиста карбонатна водна система (КВС), яка утворюється шляхом змішування деіонізованої води з вуглекислим газом (CO2+H2O) за допомогою одночасного багатопараметричного приладового контролю (електропровідності, показника іонів водню (рН) та температури) [1].
КВС утворюється при взаємодії вуглекислого газу з водою з утворенням вуглекислоти:
CO2 + H2O ↔ H2CO3, (1)
яка в подальшому дисоціює за першим і другим ступенями – рівняння (2) і (3):
H2CO3 ↔ H+ + HCO3- , (2)
HCO3- ↔ H+ + CO32-. (3)
В процесі дисоціації зміщується кислотно-лужна рівновага, яка буде зміщувати також реакцію дисоціації води (4)
Н2О ↔ Н+ + ОН- (4)
Рівняння (1) – (4) є теоретичною основою КВС, і кількісні співвідношення між компонентами КВС, враховуючи, що система є термодинамічно рівноважною, встановлюються за виразами для термодинамічних констант дисоціації вугільної кислоти по першій та другій ступеням та константи дисоціації води відповідно (5).
Please use another browser to view content, Please use another browser to view content, Please use another browser to view content(5)
де K1, K2, Kw - константи дисоціації вугільної кислоти та води. Оскільки КВС є іоногенною системою, то доцільно використати також рівняння електронейтральності (6):
СH+= CHCO3- + 2CCO32- +COH-. (6)
Оскільки одна із іонних компонент (Н+) вимірюється і рахується відомою, то розв’язуючи систему (5) - (6) по відношенню до незалежного відомого параметра Н+ легко знайти значення іонних компонент КВС, а саме НСО3-, СО32- , ОН- як функцій активностей іонів Н+ і на основі закону Кольрауша про незалежність іонних рухливостей [2], при прямуванні ступеня дисоціації до одиниці (оскільки молярні концентрації менше 10-3 моль/дм3), рівняння для розрахунку електропровідності системи буде таким:
Please use another browser to view content (7)де Сх – концентрація компонента Х, вказаного в індексованій позиції, λx - іонна рухливість компонента Х, вказаного в індексованій позиції. Звичайно, таке рівняння є певним наближенням, яке необхідно співставляти з похибками експериментального обладнання.
Оскільки у даних умовах зміни рН (4…5,5) максимальний вміст ОН- і СО32- по відношенню до вмісту іонів водню та гідрокарбонат-іонів (Н++НСО3-) не буде перевищувати 0,08 %, їх вкладом в електропровідність можна знехтувати. Враховуючи вище сказане, рівняння електронейтральності для даних умов з похибкою, яка не перевищує 0,1 % буде таким:
Н+ = НСО3-, (8)
і тоді рівняння (7) можна записати у вигляді:Please use another browser to view content (9)
де С – концентрація розчину.
Для даного діапазону концентрацій ϒ≈1, тобто а≈С, тоді з (9) отримаємо показник іонів водню, який розраховується за значеннями електропровідності:Please use another browser to view content (10)
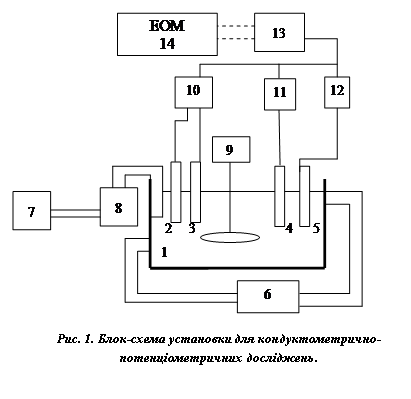
Для виконання експериментів використали спеціально розроблений у фізико-технологічній лабораторії водних систем багатопараметричний аналізатор якості водних систем [1]. Калібрувальний дослід роблять так. У термостатовану комірку 1 (рис.1) заливають деіонізовану воду і при необхідності додають електроліт KCl. У цю ж комірку поміщають рН-електрод – 2, електрод порівняння – 3, давач електропровідності – 4 і давач температури – 5. Розчин термостатують за допомогою термостата – 6 при температурі 25 ± 0,1 °С. Через розчин пропускають вуглекислий газ з балону 7 до досягнення концентрації СО2, близької до насичення. При пропусканні вуглекислого газу постійність його витрати контролюють за допомогою ротаметра 8. Після досягнення концентрації СО2, близької до насичення, розчин дегазують, перемішуючи його механічною мішалкою – 9. Сигнал від рН-електродної пари – 2, 3 і давача температури – 5 надходить на відповідні перетворювачі 10, 12, а від давача електропровідності на прецизійний кондуктометр LM-302 (Німеччина) – 12. Далі, з перетворювачів і кондуктометра, сформовані електричні сигнали надходять на плату АЦП – 13 і записуються у пам’ять комп’ютера – 14. Таким чином, базою даних такого експерименту були значення електропровідності χ і рН. За виміряними значеннями елктропровідності розраховано показник іонів водню за співвідношенням (10).
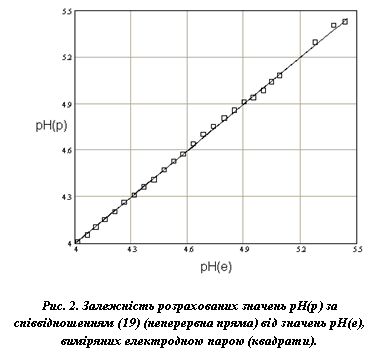
На рис. 2 порівнюється рН(р), розраховане за співвідношеннями (10) (неперервна пряма) та рН(е), виміряне електродною парою (квадрати). Статистична обробка результатів вимірювань методом найменших квадратів, показала, що похибка таких калібрувальних експериментів не перевищує ±1 %.
За результатами даних досліджень запропоновано спосіб калібрування рН-давача [3].
Список літератури
1. Гаєвський В. Р. Метрологiчнi дослiдження i випробовування аналiзатора водних систем "АКВА". / В. Р. Гаєвський, В. З. Кочмарський // Збiрник статей III наук.-техн. конф. УДАВГ. – 1997. – Ч. 5. – С. 7–10.
2. Робинсон Р. А. Растворы электролитов / Робинсон Р. А., Стокс Р. Г. пер. с англ. - М., 1963. – 647 с.
3. Пат. 16786 Україна, G01N27/06. Спосіб калібрування потенціометричного рН-давача у діапазоні рН 4 ÷ 6. / Кочмарський В. З., Гаєвський В. Р. ; заявник і патентовласник Нац. ун-тет водн. госп. та природокорист. – № u 2006 02864 ; заявл. 17.03.2006 ; опубл. 15.08.2006, Бюл. № 8.





